1、一、怎样书写电子式1.原子电子式的书写要符合孤对电子的情况,有利于学习化学键。由于原子最外层为nsnp,一个s轨道,三个p轨道,共可容纳8个电子,故可将元素符号的上下左右看成四个轨道,再分别按洪特规则填以实有的电子数。现以第2周期八种元素为例,其电子式的写法如下:这里注意的是,镁、铝、硅、磷、硫原子的电子式不应该写成如下形式:因为Mg为3s2,Al为3s23p1,Si为3s23P3PP,P为3s23P3P3P。

2、2.离子电子式的书写主要是阴离子要有方括号和离子电荷。离子电荷标在右上角,且数字在前,正负号在后。如果标在正上方,且正负号在前,符号在后,则是标能化合价符号了。阳离子除铵根离子外,一般只在元素符号的右上角标出数字和正号,而不再标出最外层电子。主族元素的原子,除氢原子外,一般最外层都是8电子的稳定结构。
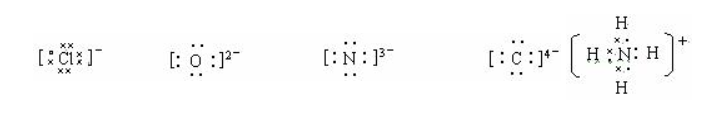
3、3.分子巡綮碣褂或共价化合物电子式的书写,要注意共价键是非极性键还是极性键;若果是非极性键,则共用电子对应处于两原子的中间;若是极性共价键,则共用电子对应偏向于吸引电子能力大(即非金属性较强)的原子,而偏离吸引电子能力小(即非金属性较弱)的原子。还要注意两原子间是共用一对电子,还是共用两对、叁对电子。如N2和CO2分子的电子式书写容易出错,可从下列书写方式加深对它们电子式的理解。从以上形成共用电子对的过程可知,N2分子中是共价叁键,而非两个三电子键。对于CO2分子情况要复杂一些,主要是C原子会通过sp3杂化形成4个等同的电子,所以出现4个成单电子,这样CO2分子中每个O原子都能与C原子形成两对共用电子对,还有两对孤对电子。这样就不会将N2和CO2分子的电子写成如下形式:对于CO分子,从下图示可知,除了有两对共用电子对外,还有一个配位键,O原子提供了一对孤对电子,C原子提供一个空轨道。

