1、在一个理想的液体溶液中 混合物中每一个组分的液相逸度与该组分的摩尔分率成正比 ,如图。理想溶液是假设溶液中所有的分子的大小是相同的并且随机分布
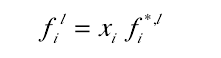
2、对于非理想混合物,活度系数γi代表混合物与理想状态的偏离程度 ,正如理想溶液定义的那样。
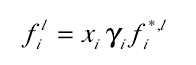
3、γi与1偏离越大 混合物越是非理想。在大多数的混合物中 γi大于1, 结果是逸度比理想体系的大。
4、逸度可以被解释为汽化的趋势 如果组分比在理想溶液中汽化的多 。那么, 它们将增加它们的平均间距 。所以 ,活度系数大于1表明了不同分子间的排斥力。 如果排斥力非常强 ,就出现了液-液分离 。这是另一个机理 即不同分子间的紧密接触减小。
5、比1小γ i是少见的 ,用相同的推理 ,可以将它解释为不同分子间强的吸引力 在这种情况下 不出现液-液分离。
6、活度系数方法中 基本的汽-液平衡关系表示如图。汽相逸度系数是由一个状态方程计算出来的,液相活度系数是由一个活度系数模型计算出来的。
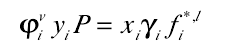
7、对于理想气体,逸度系数等于1,对于理想液体,活度系数等于1。气液平衡,两相的逸度相等,便有了拉乌尔Raoult定律,如图
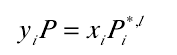
8、在低压到中压下 , 如果活度系数大于1 系统被称作与Raoults定律形成正偏差, 当活度系数小于1时 ,出现与Raoults定律形成负偏差 。