1、从医院或者红十字会血液中心取得献血者的白细胞浓缩液。

2、无菌条件下,将血袋内的血液转移至50ml无菌离心管中,2000g离心15min。离心结束,血液分为三层:从上往下:血浆、PBMCs、和红细胞层;PBMCs细胞层作为离心样品。
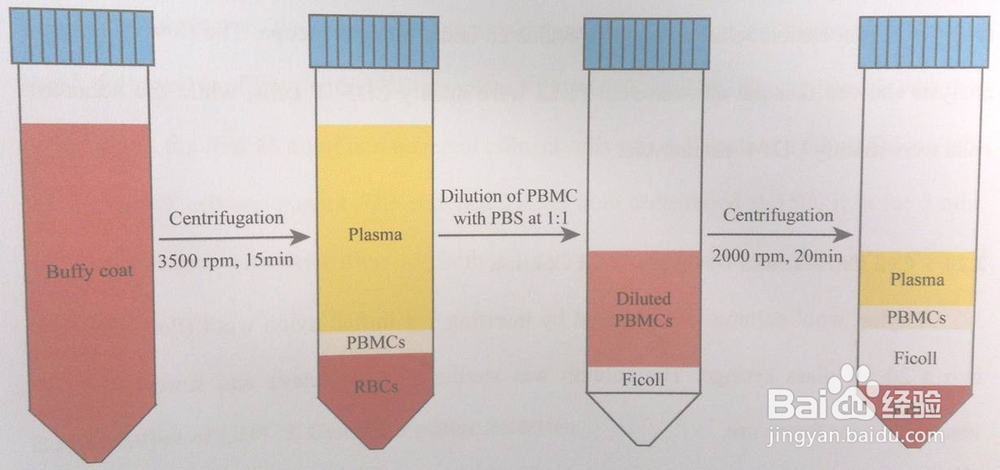
3、用3ml吸管吸去上层的血浆,再吸出乳白色的PBMCs至50 ml离心管中,将白色层的PBMCs(4-7 ml)吸至50 ml离心管中,可以尽量少吸红细胞,等体积加入室温预热的PBS溶液;
4、取一个50ml什置葆鸳离心管,加入室温预热(或37℃)的7ml Ficoll-Paque (Amersham,1.077g/ml像粜杵泳),再将样品1沿管壁小心加入至Ficoll溶液上方,800g离心30min(离心机的升速度调节为5,降速度调至0),离心结束后,50ml离心管依次分为四层:血浆、PBMCs、Ficoll层和红细胞层

5、小心将上层血浆吸去或直接吸取PBMCs细胞,在将PBMCs细胞吸至15ml无菌血清管中,加入至12ml 的PBS清洗细胞,200g离心5min,重复2-3次。
6、得到PBMCs细胞后,加入2-3倍体积的RPMI-1640培养基重悬细胞,计数,并留取 1×106 个细胞进行HLA-A2型别鉴定

7、计数取5×105个细胞铺12孔板 (根据实验要求确定需要的12孔板数楫默礤鲼目), 培养基RPMI1640含有10% FBS,37℃,5.0% CO2,培养1小时。剩余细胞按2×107cells/ml,冻存于液氮罐中

8、铺满细胞的12孔板在37℃,5.0% CO2,培养1小时后取出,吸出非贴壁细胞,收集于离心管,收集的细胞为PBLs,离心后冻存于液氮罐中
9、用预热的PBS清洗12孔板底部的贴壁细胞,吸去余下悬浮的细胞,轻轻洗细胞,重复5次诋危族枧;向贴壁的细胞加入800U/ml 的h GM-CSF,(37℃,5.0鬈熵痼霄% CO2)培养至第2天,每孔吸去一半培养基,再加入等体积的室温新鲜培养基,含有100 ng/mL GM-CSF和40 ng/mL IL-4
10、隔天半量换液,同时补加细胞因子。第6天加50ng/mL TNF-α,继续培养两天即为成熟DC
