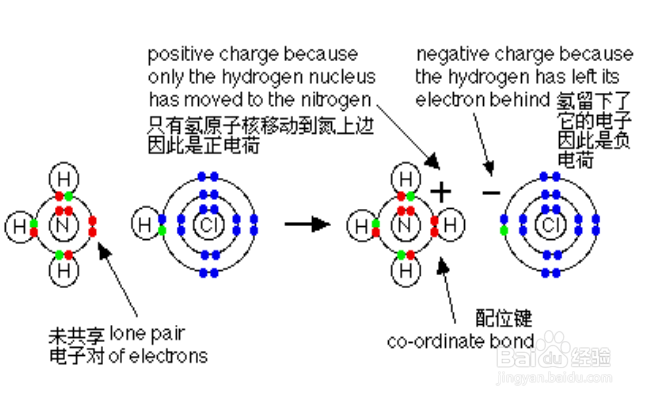
1、配位键的定义:配位键归属于共价键,而共价键由两个原子共用一对电子而形成。因为双方原子核同时吸引着这一对电子,所以原子连接在了一起。 而配位键所共有的那对电由单个原子提供(一个原子提供电子对,一个原子提供空轨道),并用“→”表示,其中,提供所有成键电子的称“配位体”、提供空轨道接纳电子的称“受体”。常见的配体有:NH3(N)、CO(C)、 CN-(C)、H2O(O)、OH-(O);受体是多种多样的:有氢离子、以BF3(硼原子)为代表的缺电子化合物、还有大量过渡金属元素。
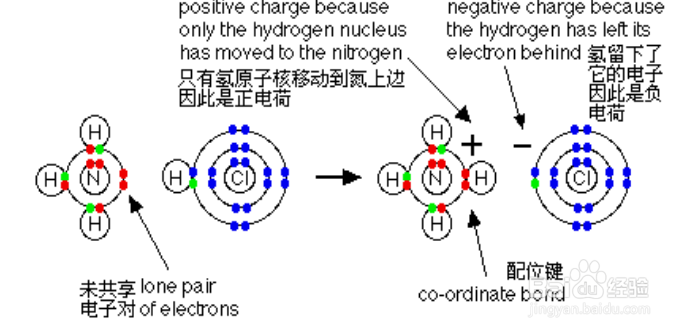
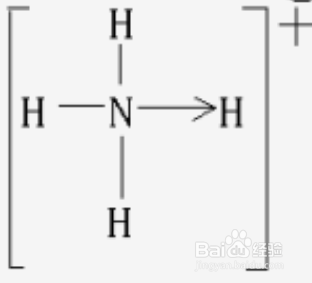
2、配位键判断方法:如果遇到某个原子所连接的键数大于(8-其最外层电子数),则含有配位键,例如NH3与NH4+的区别(N一般连三个键,而第四个键便是配位键,N提供孤对电子,H提供空轨道)
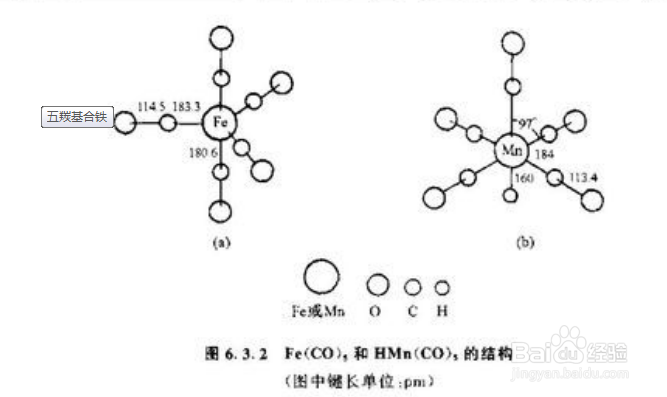
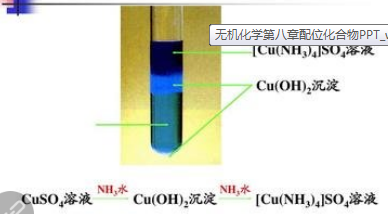
3、常见的含配位键的物质:CO(一个西格玛键两个π键,其中一个是配位键),羰基-CO例如Fe(CO)5 【Fe + 5CO = Fe(CO)5】注意Fe为0价,*选修三经典实例*:四氨合铜离子(平面正方形)【配合物离子 Cu2+: 中心金属离子 NH3:配体】高考出现过的实例:[Co(NH3)5Cl](NO3)2[Co(en)3]3+[Cu(NH3)4]2+[FeF6]3-[Cd(NH3)4]2+[Zn(NH3)4]SO4K2[HgI4][Co(NH3)5H2O]Cl3H2[PtCl6][PtCl2(NH3)2]NH4[SbCl6]Fe3[Fe(CN)6]2.
4、考试出现位置:一.选择推断题(如图)W可推断为S,但连接了6个键>2,因此存在6-2=4个配位键二.实验题1.王水(HNO3:HCl=1:3):3体积HCl带来的大量氯离子的配位作用,降低了金属的还原电位,相当于使金属的还原性增强,和硝酸强氧化性的共同作用使一些惰性金属溶解。 答案:由于Cl-具有强配位性2.银氨溶液(可将醛氧化为羧酸,并生成金属银沉积于玻璃反应器皿壁上)银氨溶液的制备:NH3·H2O + AgNO3 == AgOH + NH4NO3 AgOH + NH3·H2O == Ag(NH3)2OH + H2OAg与两个NH3配位(!!!)比例需识记三.选修大题大多数是数配位数,看图数(按照以上经验所讲即可)