1、大π键(由叫共轭π键,或离域π键)的形成有个特点,就是多个分子都是SP2杂化(SP2简并轨道形成构成分子的σ骨架,由剩余的P轨道形成共轭π键)。
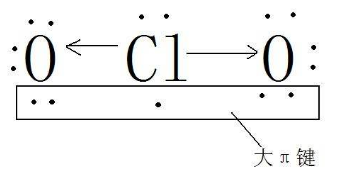
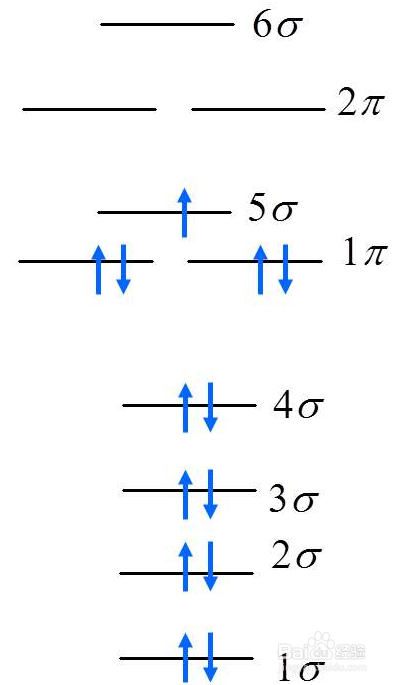
2、一般来说要判断大π键个数,就要先判断每个原子的杂化类,形成大派键的条件是各个p轨道相邻并且平行在一个平面里。
3、一个氧的满电子p轨道与C的1电子p轨道,和另一个氧的1电子p轨道式平行的,可以形成大派键.参与形成该π键的原子数为3,共有2+1+1个电子,故是π33.剩余的另一组p轨道同样如此,也是π33,.故CO2共有两个大派键,皆是π33。
4、大π键的电子数等于成键的所有p轨道电子数的总和,如苯胺,6个C的p轨道,每个含有一个电子,1个N的p轨道,含有两个电子。
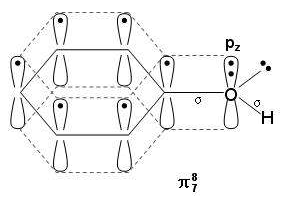
5、考虑未参与杂化的电子,参与杂化的电子不形成大π抄键,比如苯,C是sp2杂化,还有一个未参与杂化的P轨道的一袭个炼蓄晦擀电子,这个电子就参与了大π键的形成,在比如吡啶中的N也有一个zdP轨道的一个电子未参与杂化,同样参与了大π键。